ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТИЧЕСКАЯ
Спасибо нашим инвесторам из казино онлайн
ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТИЧЕСКАЯ
, распад находящихся в растворе электролитов на электрически заряженные ионы. Коеф. вант Гоффа. Вант Гофф (van
‘t
Ной) показал, что осмотическое давление раствора равно давлению, к-рое производило бы растворенное вещество, если бы оно находилось в том же объеме и при одинаковой t° в виде газа или пара. Это правило справедливо однако не для всех веществ. Многие вещества имеют осмотическое давление, превышающее то, к-рое дается теоретическим расчетом. Отношение непосредственно измеренного осмотического давления к теоретическому получило название коефи-циента вант Гоффа (г); оно всегда больше единицы: ._
Р
измеренное ,. ~~
Р
вычисленное *■
>’
Т. к. согласно кинетической теории давление (и газовое и осмотическое) при данной ^зависит исключительно от числа растворенных частиц, то для объяснения отклонений от теории вант Гоффа нужно предположить распад, диссоциацию части молекул на более мелкие частицы, в результате чего общая численность последних увеличивается. Для диссоциации газов такое объяснение было доказано путем изолирования продуктов распада. В случае растворов оно наталкивалось на значительные трудности. Если имеется напр. раствор NaCl, то продуктами диссоциации очевидно не могут быть атомы Na и С1. Оба эти элемента, если бы они находились в свободном состоянии, легко были бы обнаружены: металлический натрий бурно разлагает воду, выделяя из нее водород и образуя едкий натр, газообразный хлор

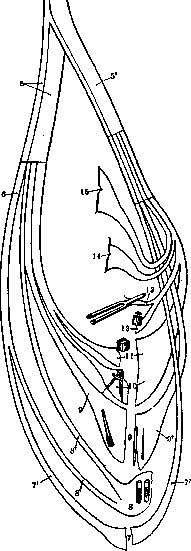
Расположение и ход чувствующих волокон в спинном мозгу и в периферическом нерве: 1 —межпозвоночный узел; 2 — клетка межпозвоночного узла; 3— симпатическая клетка; 4 —периферический ‘ чувствующий нерв; 5 —нерв кожный или проводящий поверхностную чувствительность; В1 —чувствующий нерв, идущий с нервами для мышц и проводящий глубокую чувствительность; 6—п. sympathicus; 7— болевая чувствительность; 71—укол, щипок; 7*— болезненное давление на мышцы и связки и т. д.; 8 —температурное чувство; «’—температура минимальная 26° и максимальная 38°; «’—тонкая диферепциация температуры между 22° и 40°; 9—чувство прикосновения и локализация; 91—легкое прикосновение; 9′ —давление; 10 —дискриминация чувствительности; 11 —стереогно-стическое чувство; 12— чувство тяжести; 13— костная чувствительность; 14— сознательная глубокая чувствительность: чувство положения тела в пространстве, чувство положения тела при активных и пассивных движениях; 15— бессознательная глубокая чувствительность: мышечный тонус, координация, равновесие; 1 6— периферический чувствующий неврон; 17— задний корешок; 18— корешковые волокна короткие; 19 —корешковые волокна средние; 2 О— корешковые волокна длинные; 21— пирамидные волокна прямые и Гперекрещен-вые; 22— пучок Флексига; 23— пучок Го-верса.
К ст.
Диссоциация чувствительности.
должен легко выделяться из раствора. Ничего подобного не наблюдается. Точно так же нельзя предположить диссоциации NaCl— при участии воды—на едкий натр (NaOH) и соляную кислоту (НС1); напротив, оба эти вещества, как известно, при соприкосновении мгновенно соединяются друг с другом, образуя нейтральную соль и освобождая значительные количества теплоты. Таким образом характерные признаки диссоциации газов (возможность легко распознавать и изолировать продукты диссоциации) отсутствуют в растворах. Теория Аррениуса (Arrhenius). Все вещества, растворы которых имеют ненормально высокое осмотическое давление, являются электролитами, т. е. веществами, разлагающимися при прохождении электрического тока. Согласно Фарадею (Faraday) электрический ток переносится их заряженными атомами (или радикалами), к-рые он назвал ионами. Ионы притягиваются к противоположно заряженным полюсам и выделяются на них, отдавая им свой заряд: на катоде выделяются положительно заряженные ионы, или катионы, на аноде—отрицательно заряженные анионы. Аррениус (1887) связал явления, наблюдаемые при электролизе, с гипотезой Д. э., к-рую нужно было принять, чтобы объяснить с точки зрения теории вант Гоффа аномальное осмотическое давление электролитов. Согласно Фарадею, при пропускании через раствор гальванического тока часть молекул электролита действием внешних электрических сил расщепляется на ионы. Аррениус на основании большого количества данных показал, что электролиты в растворе постоянно частично диссоциированы на ионы, независимо от того, проводят ли они в данный момент электрический ток. Т. о. известная часть молекул электролита подвергается в растворе диссоциации—«электролитической Д.» на противоположно заряженные ионы. В растворе хлористого натрия наряду с молекулами NaCl находятся ионы Na+ и С1-, или, как их упрощенно обозначают, Na’ и СГ; ионы обозначают тем же символом, что и соответствующий хим. элемент или радикал, прибавляя справа над ним столько точек или запятых, сколько он несет положительных или отрицательных зарядов (число зарядов в свою очередь равно числу валентностей). Присутствием электрических зарядов объясняются отмеченные выше характерные особенности Д. э. Продуктами Д. являются заряженные ионы, а не нейтральные атомы или молекулы; поэтому они и отличаются от последних своими свойствами. Разделение противоположно заряженных ионов посредством диффузии или какого-либо другого физ. приема невозможно, т. к. этому препятствуют значительные электростатические силы, к-рые могут быть уничтожены лишь путем нейтрализации зарядов (при электролизе). Степень Д. Одни только ионы проводят электрический ток, они же обнаруживают исключительную хим. и физиол. активность. . Крайне важно поэтому знать, какая часть всех растворенных молекул находится в таком активном, диссоциированном на ионы состоянии. Отношение диссоциированных молекул к общему числу растворенных молекул электролита называют степенью Д. и обозначают обыкновенно греческой буквой
а
(альфа). Степень Д. показывает следовательно, какая доля всех молекул находится в диссоциированном состоянии. Очевидно
а
может принимать значения, лежащие между 0 (отсутствие Д.) и 1 (полная Д.). Многочисленные измерения показали, что степень Д. возрастает с уменьшением концентрации. В достаточно разбавленных растворах наблюдается полная Д., все молекулы электролита распадаются на ионы. В следующей таблице приведена степень Д. нескольких’ электролитов. Концентрация (мол.) Степень диссоциации j КС1 СН3СООН 0,01 . 0,76 0,86 0,94 0,97 0,79 0,93 0,97 0,99 0,ОС4 0,013 0,041 0,118 I Степень Д. электролита может быть определена путем измерения осмотического давления раствора, т. к. существует простая зависимость между Д. э. и коеф.
г.
Действительно, увеличение осмотического давления, выражаемое коеф. г, тем значительнее, чем больше растворенных молекул распадается на ионы. Как показывает простой расчет, в случае бинарного электролита (т. е. электролита, распадающегося подобно NaCl на два иона) имеем: г=1 + а (2). Подставляя
г
из формулы (1), находим а. Другим, более удобным методом определения а является измерение электропроводности раствора. Т. к. в растворах только ионы переносят электрический ток, то электропроводность растет пропорционально числу свободных ионов, т. е. степени Д. э. Обозначим через
ц
молекулярную электропроводность раствора (т. е. электропроводность одной грамм-молекулы растворенного вещества). При бесконечном разведении диссоциация делается полной
, ионы всех молекул принимают участие в проведении электрического тока, и молекулярная электропроводность достигает наибольшего, предельного значения 0″оо). При большей концентрации степень диссоциации непосредственно определяется отношением молекулярной электропроводности при данной концентрации к этому предельному ее значению:
а~±
(3).
и»
Константа Д. Если рассматривать электролитическую Д. как хим. реакцию, продуктами которой являются заряженные ионы, то зависимость степени Д. от концентрации может быть выведена из общих законов хим. равновесия. Диссоциация уксусной кислоты выражается напр. уравнением: СН, СООН = СНзСОО’+ И’. Согласно закону действия масс концентрация недиссоциированных молекул к-ты про – порциональна произведению концентрации продуктов Д.: jff[CH3COOH]=[CHsCOO'].[H*]. Квадратные скобки обозначают здесь концентрацию заключенных в них веществ, а
К
представляет характерную для данной реакции постоянную, так наз. константу Д. Если с—общая концентрация растворенной кислоты, а
а
— степень ее диссоциации, то концентрация недиссоциированных молекул равна с (1—а), а диссоциированных молекул (или ионов СН3СОО’ и Н’) равна
са.
Подставляя эти выражения в предыдущее уравнение, находят:
Кс
(1 – а) =
с*а?,
или Выражаемая формулой (4) зависимость между концентрацией электролита и степенью Д. была установлена Оствальдом (Ostwald); она получила название закона разведения. Зная
К,
можно по формуле (4) вычислить а для любой концентрации. В следующей таблице приведены значения константы Д. для нескольких кислот и щелочей. Кислоты Основания Винная Молочная Уксусная Мочевая Угольная 1.10-з 1,5.10-4 1,8.10-5 1,5.10-6 3.10-’ Пиперидин Аммиак Анилин Мочевина 1,6.10-= 1,8.10-5 4,6.10-1» 1,5.10-» При одинаковой концентрации степень Д. тем значительнее, чем больше константа Д. Впрочем, т. к. все электролиты в большом разведении стремятся к одинаковому пределу—полной Д., то различия в степени Д. особенно резко проявляются в концентрированных растворах; по мере уменьшения концентрации они постепенно сглаживаются. Так напр. в нормальном растворе уксусной к-ты диссоциировано лишь 0,004 молекулы, и концентрация Н-ионов почти в 200 раз меньше, чем в эквивалентном растворе соляной к-ты (а = 0,78). В центинормальном растворе степень Д. равна 0,041, и уксусная кислота лишь в 23 раза слабее соляной. Если понизить концентрацию еще в 100 раз, то а возрастет до 0,31 и будет лишь в 3 раза меньше, чем у НС1. Д. сильных электролитов. Однако далеко не все электролиты следуют закону разведения. Он строго соблюдается лишь для большинства органических и для слабых минеральных к-т и щелочей. Большинство минеральных кислот, щелочей и солей (напр. КС1, НС1, КОН и др.) —все т. н. «сильные электролиты», имеющие даже в концентрированных растворах высокую степень Д., не подчиняются закону Оствальда. Величина
К,
вычисленная по формуле (4), не является у них константной, но быстро возрастает по мере повышения концентрации. Концентрированные растворы сильных электролитов диссоциированы значительно сильнее, чем можно было бы ожидать на основании законов хим. равновесия. Загадочное поведение сильных электролитов получило разъяснение в последние годы благодаря исследованиям Бьеррума, Мильнера, Дебая и Гюккеля (Bjerrum, Milner, Debye, Htlckel) и др. Согласно этим исследованиям сильные электролиты даже в концентрированном растворе практически полностью диссоциированы. Однако при большой концентрации начинают играть возрастающую роль электростатические силы притяжения и отталкивания, действующие между сблизившимися ионами. Эти электростатические межионные силы, к-рых не учитывала теория Аррениуса, уменьшают подвижность ионов и их электропроводность, ослабляют производимое ими осмотическое давление и другие их действия, т. е. производят все те изменения, к-рые обычно приписывают уменьшению степени Д. Наблюдаемое в крепких растворах сильных электролитов уменьшение величины
а
(см. в таблице значения
а
для КС1 и НС1) зависит следовательно не от действительного уменьшения числа ионов (степени Д.), а от уменьшения их активности. Действие сильных электролитов определяется т. о. не степенью Д. и истинной ионной концентрацией, а «активной концентрацией», или «активностью» ионов, Диссоциация и физиологическая активность. С явлением Д. неразрывно связана еще одна характерная особенность электролитов. В недиссоциированных химич. соединениях свойства компонентов исчезают, сменяясь совершенно новыми признаками образовавшегося соединения. Сернистое железо (F
eS) не обнаруживает признаков ни железа ни серы; хлороформ (СН3С1) не дает характерных для хлора реакций и т. д. Напротив, электролиты имеют. свойства составляющих их ионов. Общим для всех кислот является водородный ион, которому и приписываются все кислотные свойства: кислый вкус, способность инвертировать сахарозу, окрашивать в красный цвет лакмус и т. д. Равным образом все свойства щелочей зависят от присутствия общего для них иона—гидроксила. Ион хлора, в каком бы электролите он ни находился, осаждает серебро из его солей; ион меди придает водным растворам всех медных солей характерный для него синий цвет; ион брома производит одинаковое физиол. действие, независимо от того, с каким катионом он связан. Поэтому сильный электролит в растворе не имеет никаких индивидуальных хим. свойств. Соляная кислота напр. вполне характеризуется упомянутыми свойствами ионов Н’ и СГ. Для сильных электролитов и разбавленных растворов, в к-рых Д. можно считать полной, этот результат не является удивительным. Такие растворы представляют не хим. соединение, а смесь ионов, сохраняющих все свои особенности. Но и в более концентрированных растворах, содержащих наряду с ионами все возрастающие количества нейтральных молекул, обычно не наблюдается появления каких-либо новых свойств. Все свойства электролита являются свойствами его катиона или аниона и количественно определяются их концентрацией; только диссоциированные молекулы являются активными в химич. и физиологич. процессах. Если это справедливо, если действуют не молекулы, а их ионы, то интенсивность действия электролита должна зави – зео сеть прежде всего от степени его диссоциации. Это действительно и наблюдается. Сравним например различные кислоты. Все они производят качественно одинаковое действие, зависящее от общего для них
водородного иона
(см.). Однако при полном качественном сходстве между действием различных к-т наблюдаются резкие количественные различия. Интенсивность их действия на хим. ибиол. процессы убывает в следующей последовательности: НСГ>винная>молоч-ная>уксусиая>мочевая>угольная к-ты. В одинаковой (эквивалентной) концентрации каждый следующий член этого ряда действует слабее предыдущего и должен быть применен в соответственно более высокой концентрации, чтобы произвести одинаковый эффект. Приведенный ряд представляет ту же последовательность, в к-рой убывает константа Д. перечисленных к-т (см. таблицу). Константа Д. представляет т. о. количественную меру силы к-ты: чем более диссоциирована к-та, тем сильнее ее действие. Сходную зависимость можно установить для солей. О. на была особенно подробно изучена на ядовитых солях тяжелых металлов, в частности на ртутных солях, применяемых для дезинфекции. Как показали опыты Пауля и Кренига (Paul, Kronig) над бацилой сибирской язвы (Bacillus anthracis), из различных ртутных солей особенно ядовитой является наиболее полно диссоциированная хлористая соль (сулема), несколько меньше—бромистая, между тем как очень мало диссоциированная цианистая соль оказывается даже при более высокой концентрации наименее активной. Т. о. ядовитость возрастает параллельно степени Д. ртутной соли и зависит лишь от концентрации свободных Hg»-ионов. Концентрацию последних можно понизить и другим способом—путем добавления соли (наприм. NaCl), образующей с сулемой комплексную соль и уменьшающей степень ее Д. Действительно, по мере прибавления к HgCl2, возрастающих количеств NaCl ядовитость «раствора быстро понижается. Физиол. активность определяется не общей концентрацией электролита, а степенью его диссоциации, концентрацией его свободных ионов.
Лит.:
Вальден П., Теории растворов, Л., 1921; Изгарышев Н., Современная теория растворов, М., 1924; Рубинштейн Д., Основы физико-химической биологии, М.—Л. (печ.); А г г h е-nius S., «Ober die Dissoziation der in Wasser gelo-sten Stolfe, Zeitschr. I. physik. Chemie, Band I, 1887; H uck el E., Zur Theorie der Elektrolyte, Erg. d. exakt. Naturwiss., B. Ill, 1924; N e r n s t W., Theore-tische Chemie, Stuttgart, 1925; Paul Th. und К г 6-n i g В., Uber das Verhalten der Bakterien zu ctiemi-sehen Reagentien, Zeitschrift (. physikalische Chemie, B. XXI, 1896. Д.
Рубинштейн.