ОКИСЛЕНИЕ
Спасибо нашим инвесторам из казино онлайн
ОКИСЛЕНИЕ
, химическая реакция присоединения кислорода или отнятия водорода. Для ионных процессов общепринята более расширенная формулировка: О. есть увеличение положительной валентности (заряда> или уменьшение отрицательной валентности (заряда) иона, напр. Fe»-*Fe*» при О. солей закиси железа в соли окиси или S»_>.S0—в переходе от H2S к свободной сере. Окисление-означает потерю электронов. Из условия» •211 общей электронейтральности необходимо, чтобы при этом присутствовало-.вещество, присоединяющее электронной тем увеличивающее свою отрицательную валентность; оно называется окислителем; само. оно при этом восстановляется (см.
Восстановление).
Так. обр. процессы О. и восстановлениялтес-но связаны и должны протекать совместно. Пример: SnCl2+2FeCl3 = SnCl4+2FeCl2, или (в ионной форме) Sn»+2Fe’» = Sn*»" + 2Fe». В этой реакции ион олова окисляется, ион железа восстановляется; ион железа—-окислитель, ион олова—восстановитель. Баланс зарядов. Отсюда следует, что должен соблюдаться строгий баланс числа принятых и отданных зарядов. Это дает простой способ находить стехиометрические коефициенты при реагирующих молекулах, если известны исходные и конечные продукты. Пусть имеем реакцию О. двухвалентного марганца в виде Mn(N03)2 в ■семивалентный в виде НМп04 посредством РЬ02, к-рая при этом восстановляется в Pb(N03)2 в присутствии азотной к-ты. Окисление-восстановление можно изобразить схемой (Михайленко):
Мп» –
5 (‘) =
Мп7′
; 2
РЪ’»‘ + 2(‘)=РЪ».
Чтобы общее число пришедших и ушедших электронов было одинаково, нужно верхнюю строку умножить на 2, а нижнюю на 5. Отсюда имеем уравнение реакции: 2Mn(N03)2 + 5РЬ02 + 6HN03 = 2HMn04 + – f-5Pb(N03)2+2H20. Окислительный эквивалент. Окислительный эквивалент
п
есть число отрицательных зарядов, принимаемых окислителем; в данном примере окислительный эквивалент РЬ02 = 2. Реакции окисления-восстановления применяются между прочим в объемном анализе {см.
Оксидиметрия).
В нормальной оксиди-метрической системе принимается за единицу концентрации число граммов, равное молекулярному весу, деленному на окислительный эквивалент, в 1
л
раствора. Окислительный эквивалент может изменяться в зависимости от условий среды (см.
Оксидиметрия)
. Сила окислительного действия. Равные концентрации окислителей разной химической природы действуют неодинаково, будучи способны окислять одно вещество и являясь недостаточными для окисления другого. Далее вещество, будучи окислителем для одного вещества в одной реакции, может явиться восстановителем для другого, •более сильного окислителя в другой реакции, напо.: S02 + 3H2 = H2S + 2H20; 2S02 + + 02=2S03- Мерой силы окислительного действия является окислительный потенциал. Если построить элемент с раствором окислителя у одного химически инертного электрода и восстановителя—-у другого, растворы соединить жидким проводником, а электроды—проволокой, то по проволоке потечет ток (Ostwald). Нек-рые электродвижущие силы (потенциалы) таких элементов даны в табл. на ст. 212 (Ostwald, Bancroft). Электродвижущие силы аддитивно складываются из потенциалов отдельных окислителей и восстановителей, что видно из того, что разности соседних чисел постоянны. Отсюда получены окислительные потен – Восстановитель Окислитель КМп04 С12
(П£ОЩ
(КС1) Вг2 (KBr) К2Сг207 SnCl2 (КОН)*. . ■ 2,061 Пирогаллол & КОН) 1,680 FeS04 (нейтр.) . . 1,129 H2S03 ~.-• 1,044 FeS04 (H2SO4) • ■ 0,968 * В скобках указано, бавлены к растворам. 1,968 1,590 0,946 0,875 какие 1,723 1,366 1,348 0,984 0,428 0,705 0,345 0,628 0,268 вещества при – циалы отдельных веществ в вольтах (для ~7s моль-растворов): KMn04 (H2S04) . -1,763 Пирогаллол(КОН)-0,078 Cl2 (KC1).-1,666 FeS04 (нейтр.) . .-0,633 Вг2 (KBr).-1,425 H2S03.-0,718 К2Сг207 .-1,062 FeS04 (H2S-04) – • -0,794 SnCl2 (КОН) . . +0,301 Скорость О. не всегда соответствует силе окислительного действия. СопряженноеО. Образованием промежуточных продуктов с более высоким окислительным потенциалом во многих случаях объясняется то, что окисляющее вещество (актор), действуя на легко окисляемое вещество (индуктор), вызывает одновременное О. третьего вещества (а к ц е п-тор), к-рое само по себе не окисляется или окисляется с трудом под действием актора (сопряженные реакции). От
катализа
(см.) этот случай отличается тем, что с прекращением О. индуктора прекращается О. акцептора. Фактором индукции называется молекулярное отношение прореагировавших в единицу времени акцептора и индуктора. В типичных сопряженных реакциях он выражается небольшим целым числом. Сопряженные реакции О. помимо образования нестойкой формы О. могут быть вызваны также образованием комплексных соединений индуктора с актором или с акцептором, вообще тогда, когд
а один процесс идет за счет энергии другого, а также при образовании комплексных или нерастворимых соединений, удаляющих продукты из сферы реакции. При О. кислородом фосфора, скипидара и нек-рых других веществ, образуется озон. Здесь выделенной при О. энергии оказывается достаточно, чтобы провести процесс 02^03, требующий затраты энергии. Дальнейшие примеры сопряженных реакций О. следующие: Актор Индуктор Акцептор о2 so2 As203 Н2Сг04 FeO НМп04 FeO НС1 Н2Сг04 C2H204 Индиго Н, Сг04 Винная к-та Мп О НМп04 As203 MnO Fe203 S02 Индиго НС 103 СН20 As203 KsSaOg FeO HNO3 Zn, Cd (мет.) HMn04 Муравьиная к-та NH40H Н202 FeO, HJ О. газообразным кислородом может протекать с различной интенсивностью: медленное О., горение, взрыв. Если начальные и конечные продукты одинаковы, то и количество выделенной энергии будет во всех этих случаях одинаковым. Из случаев медленного О. наиболее важна автоокси – д а ц и я (Traube, ср. также «активированный кислород» Schonbein’a), механизм к-рой стоит в близкой связи с сопряженным О. Под автооксидацией понимают О. тел газообразным кислородом, которое происходит само собой, без всяких дополнительных воздействий. Согласно общепринятой теперь теории Баха и Энглера (Engler) процесс О. протекает в 2 стадиях: в первом присоеди-няетсяцелая молекула кислорода иобразует – • О €я перекись (с характерной группой А она обладает более сильным окислительным действием, чем молекула кислорода || , и О поэтому может окислить молекулу какого-нибудь другого вещества (сопряженная реакция) или того же самого, к-рое взято для О. {автооксидация): А+02=А[02];А[02]+В=АО + ВО
или
А[02]+А=2АО. Напр.: С6Н5.СНО + Оа=СвН5.С03Н; 2С6Н5.С03Н+ бензойный гидроперекись гидроперекись альдегид бензоила& бензоила -+(C8H3ON)2=2CeH. B.COOH.+2C8HB02N; C6H5.COsH+ индиго бензойная к-та изатин гидроперекись бензоила + С6Н5.СНО=2СбН5.СООН. бензойный бензойная к-та альдегид В случае автооксидации бензойного альдегида была выделена Бейером (Ваеуег) гидроперекись бензоила, являющаяся сильным окислителем. Иориссен (Jorissen) нашел фактор индукции, т. е. распределение кислорода между альдегидом и индиго, =1, как того требует теория. Для автооксидации характерна ее высокая чувствительность к отрицательным катализаторам. Имея в виду, что вся живая природа по-•стоянно находится в соприкосновении с таким сильным окислителем, как свободный кислород, можно удивляться ее устойчивости в этом отношении и точной регулировке О. (дыхания). Это объясняется действием мощных сопротивлений, именно наличием катализаторов-замедлителей О. (antioxy-genes no Moureu). Применение таких замедлителей имеет большое практическое значение: 1%-ная прибавка спирта к хлороформу применяется для предохранения его от быстрого загрязнения вредными продуктами О., прибавка 0,1% фенола к акролеину позволила готовить это нестойкое вещество в больших количествах. Таких примеров известно много, напр.: Вещество Замедлитель Na2S03 Бензиловый, бутиловый спир – ты, глицерин, бензойный альдегид ‘ SnCl2 Маннит, крезолы, анилин Бензойный аль – Гидрохинон дегид Щавелевая к-та Хингидрон, резорцин Адреналин, ал – Сернистая к-та калоиды Парафин Сера (при нов. t°) Жиры и масла Фенолы, танин, салигенин, ; ацетилтиомочевина и др. Шелк Соли олова, роданаты Каучук Фенолы Для замедляющего действия имеются следующие законности (Муре): замедление растет с концентрацией замедлителя (рис. 1). Замедлители—вещества, сами способные к О. В нек-рых случаях вещества из замедлителей становятся ускорителями: иод—замедлитель для О. бензойного альдегида, ускоритель для стирола. У скорителикак правило изменяют скорость реакции не очень значительно (maximum в несколько раз), тогда как замедлители могут практически совсем подавить реакцию, продолжается
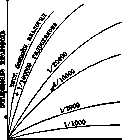
Рисунок 1.
2Н2 + С (аморфн.) + С (аморфн.) S + 2Р + Mg& + Соответственно хотя это действие повидимому не бесконечно долгое время. Экспериментально показано, что автооксидация тесно связана с полимеризацией и конденсацией (осмоление). Катализаторы у них общие. Реакции автооксидации сопровождаются свечением и светочувствительны. Определения, произведенные Бекстремом (Backstrom) для автооксидации бензойного альдегида, дали длину цепи (см. ниже) в десятки тысяч молекул для первого стадия (А+02) и значительно более короткие во втором (А[02]+А). Роль замедлителей О. сводится к обрыву цепей в первом стадии. Т. к. цепи очень длинны, то для этого достаточно прибавления очень малого количества отрицат. катализатора. Горение происходит при быстром О., сопровождаемом пламенем. Многие вещества, окисляясь, выделяют очень много тепла, например: Оа=2Н30 + 136 000 кал. 0,=СОг + 97 000 » Vs02=CO + 29 000 » Oa=S03 + 77 300 » 502=Р206 + 370 000 » 02=MgO + 143 900 » этому t° пламени достигает весьма больших величин: водорода— 2 320°; СО—2 430°; СН4—2 150°; паяльная горелка на смеси Н2 и 02 дает 3 000° и т. д. В этих случаях скорость реакции горения зависит помимо длины цепей (см. ниже) и от разогревания всей массы горящего газа. Суще-ствует и так наз. холодное пламя, при низких давлениях, при разбавлении индифе-рентным газом. Общая t° горящей смеси при этом очень мала, но энергия отдельных молекул конечно остается очень высокой. Здесь скорость реакции зависит исключительно от распространения цепей. Теория горения. Согласно
кинетической теории
(см.) скорости и энергии молекул при данной абсолютной температуре
Т
неодинаковы и распределены по закону Максвела-Больцмана. Хотя большая часть молекул имеет энергию порядка
RT (R =
= 1,98 кал.), но имеется малая дробь {& от общего числа молекул с очень большим избытком энергии. В реакцию вступают сталкивающиеся между собой молекулы реагирующих веществ, но не все, а лишь обладающие избыточной энергией (энергия активации, около 30 000 кал.). Т. о., чтобы молекулы прореагировали, необходимо пре –
215 ‘
&
ОКИСЛЕНИЕ
216
дварительно подвести энергию. Так, чтобы уголь загорелся, его нужно нагреть. Выделяющаяся при реакции теплота, нагревая смесь, сможет снова доставить энергию активации. Т. к. с повышением температуры чис –
е
ло активных молекул I очень быстро возрастает, то скорость реакции также быстро возрастает, обычно при нагревании на 10° в 2 раза. При повышении t° О. от 200° до 2 200° скорость реакции увеличивается в 10й раз.—Реакции горения суть цепные реакции. Каждый первичный акт реакции молекулы с кислородом является началом энергетической цепочки: образовавшаяся молекула в первый момент своего появления несет очень большую энергию; столкнувшись с молекулой исходного вещества, она передает ей свою энергию, эта вторая молекула становится активной, реагирует, процесс повторяется далее и идет цепью. Т. о. число активных молекул значительно увеличивается сравнительно с первоначальным. Константа скорости реакции (число реагирующих в единицу времени молекул при давлении, равном единице)
W=n-{-aW,
где
п
—число первоначально активных молекул и
а
—вероятность активирования молекулы, столкнувшейся с прореагировавшей. Отсюда W = ^; j^ есть длина цепи, т. е. число вторичных актов реакции, вызываемых первичными. Длина цепей достигает величин порядка 104—10е. Если в своем продвижении такая цепь встретит молекулы, которые, поглощая энергию, не реагируют дальше, напр. молекулы постороннего вещества (стенки сосуда), то цепь обрьюается. Т. о. скорость горения зависит от диаметра сосуда. В капилярах (& 3,5
мм)
горение не идет, так как цепи слишком быстро обрываются и газ не успевает разогреваться. На этом основано действие предохранительной лампы Деви для углекопов, применение водяных бань с предохранительными металлическими сетками в лаборатории и т. д. Температура воспламенения. При низких t° скорость реакции мала, и выделяемое тепло уводится стенками сосуда (медленное О.). С повышением t° скорость реакции увеличивается быстро (пропорцио –
е
нально
I
), отвод тепла—медленно (про – порционально t°). При темп., когда тепло-приход уже не компенсируется теплоотво-дом, получается лавинообразное увеличение скорости и как следствие—взрыв, горение. Это и есть t° воспламенения. Температуры воспламенения в смесях с воздухом при атмосферном давлении: СО, СН4—650°, Н2—5 50°, С2Н2—450°, CSa—350°, РН3—100°. Зависимость от дав л ения. Когда скорость горения зависит от разогревания всей массы газа (см. выше), t° воспламенения зависит от
давления. Скорость реакции по закону действия масс пропорциональна давлениям реагирующих газов и кислорода, а теплоприход пропорционален скорости реакции. Пусть давление и скорость реакции малы и теплоприход
Q
в зависимости от t° выражается кривой
3,
а теплоотвод—наклонной прямой (рис. 2). Если реакция О. началась при tp
T0,
то теплоприход больше
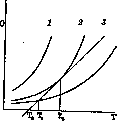
Рисунок 2.
теплоотвода и смесь разогревается до ТХг где эти величины сравняются. Дальше разогревание не произойдет, т. к. теплоприход, уже меньше возможного теплоотвода (прямая выше кривой 3). Т. о. взрыва нет. При большем давлении достигается условие (кривая 2) , что прямая касается кривой в точке Т2, выше нее тепло-отвод остается меньше теплоприхода, а скорость реакции чрезвычайно быстро увеличивается—пр оисходит взрыв. Если давление еще выше (кривая 1), теплоотдача всегда меньше теплоприхода _ и быстро наступает взрыв. Т. о. существует низший предел воспламеняемости, зависящий от давления. Из этих критических давлений можно вычислить энергию активации (Семенов). Понижение t° воспламенения при сжатии, т. е. воспламенение сжатием, использовано в моторе Дизеля. Впрыскивая бензин в воздух, сжатый до 50 атмосфер, вызывают его моментальное воспламенение; t° газа повышается при этом до 1 000°. Т. н. антидетонаторы (тетраэтил-свинец и др.) повышают t° воспламенения, обрывая цепи, и позволяют использовать более высокие давления. Существуют пределы воспламенения в зависимости от состава смеси. Горение в смесях с воздухом происходит лишь при содержании: На—от 10% до 70% Н„ СО—от 16% до 75% СО, светильн. газа—от 8% до 25% газа. Когда одного компонента слишком много, горение не может распространяться, так как выделяющаяся при реакции между молекулами энергия растрачивается без распространения цепей. Аналогичное разбавляющее действие производит прибавление негорючего газа. Интересно далее существование верхнего предела давления для горения смесей, выше которого они не загораются. Распространение горения. Если поджечь с одной стороны горючую смесь, заключенную в горизонтальную длинную (несколько метров) трубку, то распространение горения—вначале небыстрое, равномерное— быстро ускоряется, производя колебания, часто звук. Конечной фазой, встречающейся, правда, не всегда, является т. н. взрывная волна, т. е. волна сжатого-(до 50 атм.) газа очень высокой t°. Скорость ее распространения очень постоянна и соизмерима с молекулярными скоростями, откуда можно вычислить последние. Объемный состав смеси Скорость взрывной волны (метры в секунду) СаН2 + Оа СН4 + Оа 3 530 1& 710 2& 900 2 528 1 Замечательно, что сухие смеси с кислородом (СО, паров серы, Р, С) не горят (содержание воды & 0,0001%). О. атомарным кисл ор од ом. При пропускании кислорода через разрядные* трубки (3 000 V, 250 тА) при давлениях около 1 мм можно получить газ, содержащий до 30% атомарного кислорода (совершенно аналогично получению атомарного, «активного» водорода). При диссоциации молекулы кислорода поглощается 126000 кал.; ясно, что атомы обладают большим запасом энергии. Поэтому, встречаясь с парами большинства органических веществ, они производят очень энергичное окислительное действие, сопровождающееся свечением. Контакты о-к аталитическоеО. Твердые поверхности могут не только препятствовать О. (см. выше), но и ускорять его. Последнее, каталитическое действие в значительной степени зависит от хим. природы поверхности. Механизм этого действия может быть различен. 1) На стенках могут появляться центры, откуда начинаются новые цепи, например вследствие того, что энергии адсорпции или хим. действия стенки бывает достаточно, чтобы расщепить молекулу и выслать образовавшиеся группы или свободные атомы в объем, где они и начинают цепочки. Таков по Габеру (Haber) механизм катализа гремучей смеси кварцем, высылающим в объем группы ОН, всегда имеющиеся на его поверхности. Такой механизм окислительных реакций особенно вероятен вследствие большой их экзотер-мичности. 2) Другой механизм признает Ленгмюир (Langmuir) для соединения с кислородом молекул СО и Н2 на поверхности платины. Кислород, адсорбированный платиной, распадается на атомы, остающиеся на поверхности. Реакция происходит при каждом ударе молекулы СО или На из газовой фазы с поверхностными атомами О. Образовавшиеся молекулы С02 или Н20 быстро улетают, возобновляя свободное место для следующего подобного цикла. Эти свободные места могут заниматься непроизводительно молекулами СО или Н2 или молекулами. продуктов реакции, и тогда происходит уменьшение действующей поверхности. Процессы каталитического окисления получили громадное применение на практике—поверхностное сжигание топлива, контактный способ получения серной кислоты, О. аммиака в азотную кислоту, процесс Дикона, конверсия метана, получение ацет-альдегида из спирта, фталевого ангидрида из нафталина, бензойной кислоты из толуола, антрахинона из антрацена и т. д. Ката